研究内容
新規アデノ随伴ウイルス(AAV)ベクターの開発、及びAAVベクターを駆使した脳神経系の生理病態研究を遂行しています。
1. 目覚ましい発展を遂げるAAVベクター
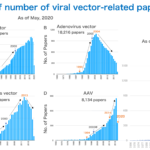
2020年前半に作ったグラフですが、ウイルスベクターの論文は1980年ごろから一貫して増加しています。ただ詳しくみるとこの間、使用されるウイルスベクターの種類の移り変わっているのがわかります。アデノウイルスベクターの論文は1990年代より急激に増えていますが、2004年ごろをピークに減少、レンチウイルスベクターの論文は1986年からコンスタントに増加し、2013年ごろから減少、AAVベクターの論文は1994年ごろから増え始め、2014年ごろから増加が加速しているのがわかります。2023年6月現在、3年ぶりにAAVの論文を検索すると、増加スピードが加速していることがわかりました。AAVベクターを用いた遺伝子導入は生命科学研究からヒトへの臨床応用まで目覚ましい発展を遂げています。
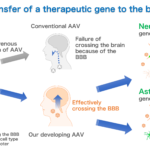
静脈内投与したAAVは、血液脳関門があるためほとんど脳内に侵入しません。私たちは、効率的に血液脳関門を通り抜け、脳内でニューロンやアストロサイトなど標的とする細胞種特異的な遺伝子発現を可能にするAAVベクターの開発を目指しています。これを達成するために必要になるのが、BBBを効率的に通り抜け標的細胞に親和性をもつカプシド、さらに標的細胞種でだけ働く細胞種特異的プロモーターです。
2. 脳の細胞種特異的AAVベクターの開発
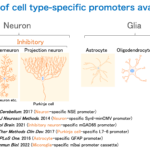
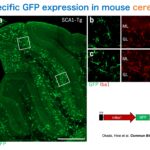
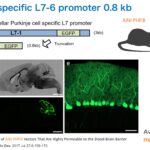
脳内にはニューロンとグリア細胞があり、ニューロンには興奮性と抑制性、グリア細胞にはアストロサイト、オリゴデンドロサイト、ミクログリアなどがあります。我々はこれまでに、AAVで使える様々な細胞種特異的プロモーターを開発し、ほぼ全ての細胞種において特異的な遺伝子発現が可能になっています。いかにミクログリアと小脳プルキンエ細胞の例を示します。
Okada Y, Hosoi N, Matsuzaki Y, Fukai Y, Hiraga A, Nakai J, Nitta K, Shinohara Y, Konno A, Hirai H.
Development of microglia-targeting adeno-associated viral vectors as tools to study microglial behavior in vivo.
Commun Biol. 2022 Nov 11;5(1):1224. doi: 10.1038/s42003-022-04200-3.
Nitta K, Matsuzaki Y, Konno A, Hirai H
Minimal Purkinje Cell-Specific PCP2/L7 Promoter Virally Available for Rodents and Non-human Primates.
Mol Ther Methods Clin Dev. 2017 Jul 27;6:159-170.
3. 静脈内投与で血液脳関門(BBB)を通り抜け、全脳に遺伝子導入できるAAVベクターの開発
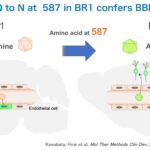
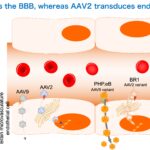
AAV9カプシドベクターは静脈投与すると脳内血管内皮細胞をわずかに透過するのですが、AAV9カプシドの変異体であるPHP.BやPHP.eBは、遥に効率的に血管内皮に取り込まれて通り抜けます。一方、AAV2はわずかに血管内皮細胞に取り込まれたのち、通り抜けずに核に運ばれて血管内皮で遺伝子発現します。BR1はAAV2の変異体で、野生型のAAV2より顕著に血管内皮に取り込まれ、その後、AAV2と同様、通り抜けずに内皮細胞で遺伝子発現します。すなわち、これらは脳内血管内皮細胞に効率的に取り込まれる性質を獲得した変異体であり、細胞内に入った後は、それぞれの性質であるtranscytosis、transductionを起こすと言えます。
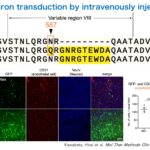
BR1はAAV2カプシドのVariable region VIIIに9個のアミノ酸が挿入されていますが、これに加えて587番目のアスパラギンがグルタミンに変わっています。私達は、オリジナル論文とは異なる方法でBR1を作製したので、587番目のNが変わらずにNのままでした。これをBR1Nと名付けました。特にNのままでも問題はないだろうと考えBR1Nを、マウスに静注したところ、BBBを通り抜けてニューロンに遺伝子発現することがわかりました。
すなわちカプシドの587番目のアミノ酸がグルタミンであるBR1は血液脳関門を通り抜けず、血管内皮に遺伝子発現するのに対し、587番目のアミノ酸がアスパラギンであるBR1Nは通り抜けてニューロンで遺伝子発現することがわかりました。
Kawabata H, Konno A, Matsuzaki Y, Hirai H.
A blood-brain barrier-penetrating AAV2 mutant created by a brain microvasculature endothelial cell-targeted AAV2 variant.
Mol Ther Methods Clin Dev. 2023 Mar 2;29:81-92. doi: 10.1016/j.omtm.2023.02.016. eCollection 2023 Jun 8.
これらの結果から、AAV9だけでなく様々なAAV血清型からBBB透過型カプシド変異体が作製できるのではないかと考えています。このような研究に加えて、現在、マーモセットの血液脳関門を通り抜けるAAVカプシド変異体の開発を行っています。
日本語の総説など
- 平井宏和. ウイルスベクター静脈投与による脊髄小脳変性症動物モデルの作出. Clinical Neuroscience. 37巻8号(印刷中)
- 今野歩, 平井宏和. ウイルスベクターの静脈投与によるマウス脳全域への遺伝子導入. 実験医学. 2019; 37(4): 581-587.
- 平井宏和. 遺伝子導入. 脳科学辞典; 2018. doi:10.14931/bsd.7623
- 平井宏和. ウイルスベクター. 脳科学辞典; 2018. doi:10.14931/bsd.7632
- 平井宏和. バクロフェンで脊髄小脳失調症1型の運動失調がよくなるのか?全国脊髄小脳変性症(SCD)・多系統萎縮症(MSA)友の会ニュース. No. 226: 10-14. 2017.04.25発行.
- 平井宏和. “ニューロン特異的エノラーゼ(NSE)”は炎症があるとニューロンではなくグリア細胞で産生される. 生化学. 2017; 89(2): 241-243. doi:10.14952/SEIKAGAKU.2017.890241
- 平井宏和. 小脳の機能(基底核と小脳−その相違と連関)Clinical Neuroscience. Vol.35 (17年01月号): 28-32. 2017.01.01発行.
- 平井宏和. 脊髄小脳変性症・多系統萎縮症に対する幹細胞研究の現状 『脊髄小脳変性症・多系統萎縮症 Q&A 172』 平成27年3月発行
 .
. 
 .
.